| Ngôn ngư : |
|
|
| Cộng đồng Bách khoa toàn thư |Bách khoa toàn thư Đáp |Gửi câu hỏi |Kiến thức từ vựng |Kiến thức upload |
Trước 1 Tiếp theo Chọn trang
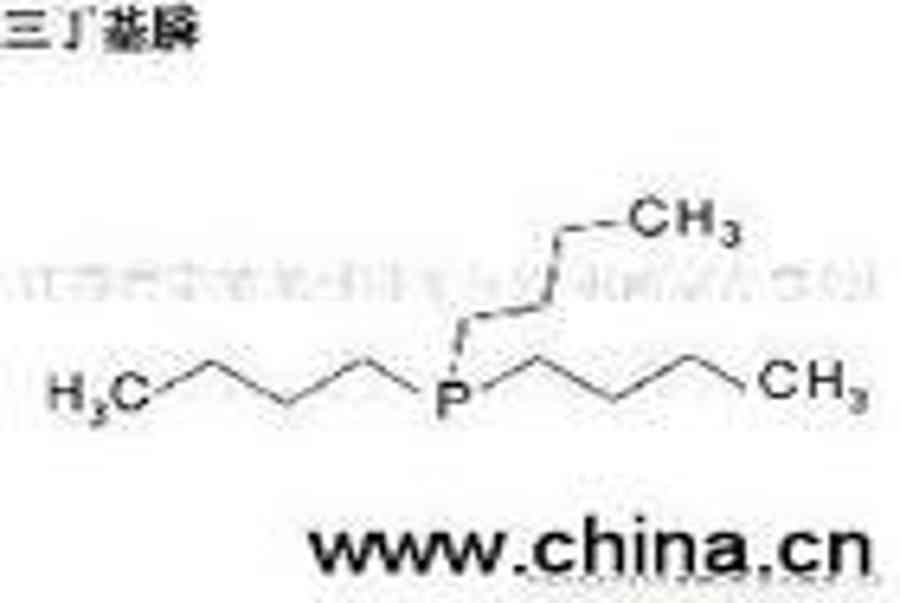
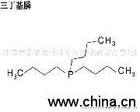
Phosphine |
|
|
Tính chất vật lý
Thường dùng để chỉ phosphine (PH3). Ở nhiệt độ phòng, phosphine là không màu, khí cực kỳ độc có mùi tỏi. Điểm nóng chảy của phosphine 140K, điểm sôi của 185.3K. Tính chất hóa học Bính âm: Lin. “Phosphine” cũng đề cập đến phosphine Kỳ (P2H4). Kỳ phosphine m.p. 174.2K, điểm sôi của 328.2K. Ở trên nhiệt độ phòng, phosphine Kỳ sẽ bị phân hủy khi tiếp xúc với không khí ngay lập tức sẽ cháy. PH3 phương pháp chuẩn bị là: 1) kim loại phospho phản ứng với nước, 2) chất phốt pho trắng và dung dịch kiềm (30%) có hiệu lực. Ca3P2 6 H2O ==== 3Ca (OH) 2 2 PH3 ↑; P4 3 NaOH 3 H2O ==== PH3 ↑ 3 NaH2PO4 PH3 là khí rất độc hại, không khí là số tiền tối đa cho phép của 0.3ppm. PH3 khí dicromat có sẵn, axit cromic, bạc, carbon, hấp thụ dung dịch thuốc tẩy. Theo dõi PH3 sẵn silicone đen bạc nitrat trường hợp được chỉ định. Nhôm phosphide, kẽm phosphide nước tạo ra PH3, được sử dụng như một loại thuốc trừ sâu xông hơi khử trùng kho. PH3 hòa tan trong nước là nhỏ hơn so với NH3 (không liên kết hydro) nhiều, amoniac là khoảng 1/2600, và chỉ hòa tan nhẹ trong nước là kiềm, yếu hơn nhiều so với NH3. Rất khó để tạo thành một phosphonium (PH4 ) muối, chỉ liên quan đến vai trò superacid (như HI, HClO4) được tạo ra muối phosphonium (ví dụ PH4I). PH4I nước thủy phân hoàn tất, PH3 và HI, các ion phosphonium không tồn tại trong dung dịch nước. PH3 tự bốc cháy trong không khí, điều này là không dễ dàng, nhưng tổng PH3 chứa P2H4, sẽ đốt cháy PH3 (nhiệt độ tự động đánh lửa khoảng 423.2K). PH3 khử bạc khử mạnh, các ion đồng: PH3 6 AgNO3 3 H2O ==== 6Ag H3PO3 6 HNO3 PH3 8CuSO4 4H2O = H3PO4 4H2SO4 4Cu2SO4 6CuCl 2 PH3 ==== 2Cu3P 6 HCl 8CuCl PH3 4 H2O ==== H3PO4 8 Cu 8 HCl Phosphines Phosphine phân tử một số hoặc tất cả các nguyên tử hydro của một hợp chất phốt pho hữu cơ hóa trị ba hydrocacbyl-thay thế. Có thể được chia thành một phosphine RPH2, hai và ba phosphine R2PH loại R3P phosphine. Mùi hôi thối và độc phosphine. Tính chất hóa học của các nguyên tử phốt pho duy nhất cặp electron liên quan chặt chẽ với tính chất, số lượng amin tương tự, với một thuốc thử ái và hiệu suất cơ sở. Như phosphine nguyên tử có bán kính ion lớn và âm điện thấp, trở ngại về không gian của trạng thái chuyển tiếp nó có tác dụng chút ái phosphine lớn hơn các hợp chất nitơ tương ứng. Phosphine và trung cấp phosphine thấp hơn tương ứng với hợp chất nitơ cơ bản, đó là do chất phốt pho nguyên tử duy nhất cặp electron quỹ đạo có một tính năng s lớn hơn, và duy nhất electron cặp nguyên tử nitơ là sp3 quỹ đạo, dễ dàng kết hợp với một proton. Ngoài ra, quá trình phosphine hiệu ứng dung môi proton là yếu. Như các nguyên tử phốt pho vỏ electron hóa trị đến 10, do đó, một hợp chất phốt pho hóa trị ba như vậy có lực điện tử, phụ huynh, và các đặc điểm khác dienes mối quan hệ. Phosphine nhiều phản ứng là hình thức phosphoryl một liên kết mạnh mẽ (P = O) là động lực. Ba phosphine dễ bị oxy hóa không khí của trialkyl phosphine oxide, một phosphine như methyl phosphonit MePH2 trong không khí có thể là tự phát, ổn định triphenylphosphine trong không khí, nhưng có thể được oxy hóa. Đối xứng trialkylphosphine phối tử đặc biệt triphenylphosphine là tốt, kim loại dễ dàng và chuyển đổi sang hình thức trái phiếu kim loại phosphate, khu phức hợp này hòa tan trong các dung môi hữu cơ có thể được sử dụng như một chất xúc tác đồng nhất, một phức hợp kim loại và phosphine bản chất của quyết định trên σ trái phiếu, trái phiếu π và trở ngại về không gian. |
Trước 1 Tiếp theo Chọn trang
| Người sử dụng Xem lại |
|
Không có bình luận nào
Tôi muốn nhận xét [Visitor (35.245.*.*) | Đăng nhập ] Ngôn ngư : |
|
版权申明 | 隐私权政策 | Bản quyền @2018 Thế giới kiến thức bách khoa
![]()
Source: https://final-blade.com
Category: Kiến thức Internet